Ikatan Kimia
IKATAN KIMIA
Ikatan kimia terjadi karena adanya gaya tarik-menarik yang kuat antara atom-atom di dalam suatu senyawa. Kekuatan gaya tarik menaik antar atom-atom yang berikatan menentukan sifat kimia dari senyawa yang terbentuk. Jenis ikatan kimia yang terbentuk bergantung pada struktur elektron atomnya. Tujuan pembentukan ikatan kimia ini agar atom mencapai kondisi stabil.
A. Kondisi
Stabil
Unsur-unsur selalu berusaha mencapai kondisi stabil dengan energi terendah. Hal itu dilakukan dengan mengurangi, menambah atau menggunakan bersama elektron valensinya pada ikatan kimia. Gilbert N. Lewis, Langmuir (Amerika), dan Kossel (Jerman) tahun 1916 mengemukakan bahwa unsur-unsur atom gas mulia sulit bereaksi dengan atom lainnya. Sifat ini disebabkan keunikan konfigurasi elektronnya.
Tabel 4.1 Konfigurasi elektron
unsur-unsur golongan VIII A
|
No |
Unsur |
Konfigurasi elektron |
Jumlah elektron valensi |
|
1. |
2He |
1s2 |
2 |
|
2. |
10Ne |
1s2 2s2 2p6 |
8 |
|
3. |
18Ar |
1s2 2s2 2p6 3s2 3p6 |
8 |
|
4. |
36Kr |
1s2 2s2 2p6 3s2 3p6
4s2 3d10 4p6 |
8 |
|
5. |
54Xe |
[Kr] 5s2 4d10 5p6 |
8 |
|
6. |
86Rn |
[Xe] 6s2 4f14 5d10 6p6 |
8 |
Dari data yang kita peroleh, kulit terluar unsur-unsur gas mulia terisi 8
elekton kecuali helium memiliki 2 elektron pada kulit terluar.
Berdasarkan konfigurasi elektron gas
mulia, Lewis dan kawan-kawannya memberikan gagasan tentang bagaimana cara suatu
atom berikatan atau bersenyawa dengan atom lain.
Atom-atom yang
bukan gas mulia dalam mencapai kestabilannya berupaya untuk mempunyai elektron
valensi atom seperti gas mulia, yaitu 2 untuk unsur dengan nomor atom 1-5 dan
electron valensi untuk atom-atom unsur lainnya
Kecenderungan
unsur-unsur lain mencapai konfigurasi stabil dengan elektron valensi 8 disebut
dengan hukum oktet, sedangkan kecendrungan mencapai konfigurasi stabil
dengan elektron valensi 2 disebut hukum duplet.
Suatu
atom dapat mencapai kestabilan konfigurasi elektron atom gas mulia dengan
beberapa cara bergantung pada kondisi atom itu sendiri. Ada 4 cara atom
mencapai kestabilan, yaitu :
1. Pelepasan elektron
Cara ini dilakukan oleh atom-atom yang
memiliki elektron valensi 1, 2, atau 3 elektron.
Contoh
:
v
11Na :
2 8
1
Jika dibandingkan dengan konfigurasi
atom Ne, atom Na kelebihan 1 elektron. Konfigurasi Ne dapat dicapai dengan cara
Na melepaskan 1 elektron sehingga atom Na berubah menjadi ion Na+.
Reaksinya : Na → Na+ + 1 e
2 8
1 2 8
v
12Mg :
2 8
2
Atom Mg melepaskan 2 elektron valensinya sehingga mencapai
kondisi stabil seperti Ne membentuk ion Mg2+.
Reaksinya
: Mg
→ Mg2+ + 2 e
2 8
2 2 8
Dari fenomena di atas dapat disimpulkan bahwa : Atom-atom logam mencapai kestabilan
elektronadengan melepaskan
elektron.
2. Penangkapan elektron
Suatu atom akan menangkap elektron jika kekurangan 1, 2, atau 3 elektron untuk
mencapai konfigurasi elektron seperti
atom gas mulia yang terdekat.
Contoh :
v
9F : 2 7
Atom F memiliki elektron valensi 7, sehingga untuk
mencapai konfigurasi seperti atom Ne membutuhkan 1 elektron, sehingga atom F
akan menangkap l elektron. Setelah menangkap 1 elektron, atom F akan berubah
menjadi ion F-.
Reaksinya : F + e- → F-
2 7 2 8
v 16S : 2
8 6
Atom S memiliki elektron valensi 6, sehingga untuk
mencapai konfigurasi seperti atom Ar membutuhkan 2 elektron, sehingga atom S
akan menangkap 2 elektron. Setelah menangkap 2 elektron, atom F akan berubah
menjadi ion S2-.
Dari fenomena di atas dapat disimpulkan bahwa : Pada umumnya unsur nonlogam cenderung
menangkapaelektron untuk mencapai
keadaan stabil atau membentuk ion negatif.
3. Penggunaan Pasangan
Elektron Bersama
Penggunaan
pasangan elektron secara bersama-sama dapat terjadi pada atom yang mempunyai
keelektronegatifan tinggi atau atom yang sukar melepaskan elektronnya.
Penggunaan pasangan elektron terjadi
pada unsur-unsur sesama nonlogam yang berikatan, karena unsur-unsur tersebut
sama-sama cenderung untuk menarik elektron. Dalam hal ini elektron dari kedua
unsur digunakan bersama-sama dan membentuk pasangan elektron. Jumlah elektron
yang dipasangkan atau digunakan secara bersama-sama disesuaikan dengan keadaan kebutuhan masing-masing atom
sehingga masing-masing mencapai susunan oktet atau duplet khusus untuk
hidrogen.
4. Menerima
Pasangan Elektron
Masih ada cara lain untuk mencapai stabilnya suatu atom,
yaitu dengan menerima pinjaman pasangan elektron dari unsur lain yang sudah
mencapai kondisi stabil. Pasangan elektron tersebut tidak diberikan kepada unsur yang belum
stabil tetapi digunakan bersama-sama dan menjadi milik bersama antara kedua
atom.
B. Ikatan Ion
Ikatan ion merupakan gaya elektrostatik antara ion
positif dengan ion negative dalam sebuah lattice
kristal ion.
Ion dibentuk dengan cara melepaskan atau menangkap
electron.
- v Ion positif
dibentuk ketika sebuah atom melepas satu atau lebih electron. Logam biasanya
melepaskan electron dan membentuk ion positif.
- v Ion negative
dibentuk ketika sebuah atom menangkap satu atau lebih electron. Unsur yang
melakukan penangkapan electron adalah unsur non-logam.
Muatan ion bergantung pada jumlah electron yang
dilepas atau ditangkap.
Jika unsur logam dikombinasikan dengan unsur non logam, electron terluar dari atom logam akan ditransfer kepada unsur nonlogam. Setiap unsur nonlogam akan menangkap electron untuk memenuhi kulit terluarnya. Sehingga baik atom unsur logam maupun non logam kulit terluarnya akan terpenuhi electron seperti konfigurasi gas mulia.
C. Ikatan Kovalen
Jika
unsur non logam berikatan dengan unsur non logam apa yang akan terjadi?
Masing-masing unsur membutuhkan elektron untuk mencapai keadaan stabil, jadi
tidaklah mungkin jika ada yang mau menyerahkan elektronnya kepada yang lainnya.
Untuk membentuk ikatan dilakukan dengan penggunaan
pasangan elektron antar unsur-unsur
sesama nonlogam yang berikatan, karena unsur-unsur tersebut sama-sama cenderung
untuk menarik elektron. Dalam hal ini elektron dari kedua unsur digunakan
bersama-sama dan membentuk pasangan elektron. Jumlah elektron yang dipasangkan
atau digunakan secara bersama-sama disesuaikan
dengan keadaan kebutuhan masing-masing atom sehingga masing-masing
mencapai susunan oktet atau duplet khusus untuk hidrogen.
1. Ikatan Kovalen Tunggal
Contoh 1.
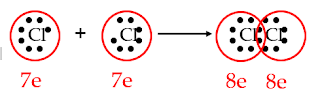
Pembentukan ikatan kovalen pada molekul Cl2.
Konfigurasi elektron :
17Cl : 2
8 7 membutuhkan
1 elektron
17Cl : 2
8 7 membutuhkan 1 elektron
Gb. 4.9.
Struktur Lewis Pembentukan Ikatan Molekul Klorin
Untuk mencapai kestabilan kedua atom Cl saling
meminjamkan 1 elektronnya, sehingga
terbentuk susunan oktet seperti konfigurasi elektron argon.
Contoh 2. Pembentukan ikatan kovalen pada molekul H2.
Gambar Proses pembentukan ikatan kovalen H2
Untuk mencapai kestabilan kedua atom H saling meminjamkan
1 elektronnya, sehingga terbentuk
susunan duplet seperti konfigurasi elektron He
Contoh 3. Pembentukan ikatan H dengan Cl
Konfigurasi elektron :
1H : 1 membutuhkan 1 elektron
17Cl : 2, 8, 7 membutuhkan 1 elektron
Gambar 4.11. Proses pembentukan ikatan senyawa HCl
Karena masing-masing atom membutuhkan 1 elektron, maka 1 elektron atom H berpasangan dengan 1 elektron atom Cl, sehingga atom H menjadi duplet sedangkan atom Cl menjadi oktet. Ikatan yang terbentuk antara atom H dan atom Cl adalah ikatan kovalen tunggal.
Daftar pustaka
Chang, Michael. Chemistry. New York: Mc. Graw Hill, 2017.
Graham Hill, John Holman. Chemistry in Context. United Kingdom: Nelson Thornes, 2000.
Roger, Ryan Lawrie dan Norris. Chemistry Coursebook Cambridge International AS and A Level. New York: Cambridge University Press, 2014.



Komentar
Posting Komentar