Kesetimbangan Kimia Kelas XI
Kesetimbangan Kimia
A. Pengertian
Kecepatan Reaksi pada Sistem Kesetimbangan
![]()
Pada
awal reaksi, konsentrasi A dan B pada mula-mula ada pada titik maksimum, dan
itu berarti kecepatan reaksi juga ada pada titik maksimum. Seiring berjalannya waktu, A dan
B bereaksi dan konsentrasinya berkurang laju reaksi maju. Ini berarti, jumlah
partikelnya berkurang dan kesempatan bagi partikel A dan B untuk saling
bertumbukan dan bereaksi berkurang, dan ini menyebabkan kecepatan reaksi juga
berangsur-angsur berkurang pada saat itu hasil reaksi bertambah dan laju reaksi
balik naik. Pada saat reaksi mencapai titik tertentu yang menunjukkan laju
reaksi maju = laju reaksi balik maka kesetimbangan kimia terjadi.
Kesetimbangan kimia terjadi
pada saat Anda memiliki reaksi timbal balik di sebuah sistem tertutup. Tidak
ada yang dapat ditambahkan atau diambil dari sistem itu selain energi. Pada
kesetimbangan, jumlah dari segala sesuatu yang ada di dalam campuran tetap sama
walaupun reaksi terus berjalan. Ini dimungkinkan karena kecepatan reaksi ke
kanan dan ke kiri sama.
C. Faktor-faktor yang Mempengaruhi
Reaksi Kesetimbangan Kimia
Dalam keadaan
kesetimbangan, konsentrasi masing-masing komponen tidak berubah. Percobaan kali
ini akan mengamati apa yang terjadi pada sistem kesetimbangan jika konsentrasi
satu atau semua komponen diubah oleh “pihak lain”.
Contoh : Diketahui reaksi setimbang :
Ketiga zat ini berada dalam keadaan setimbang dalam ruang tertutup.
Jika ditambah zat A, maka kesetimbangan akan bergeser ke arah kanan sehingga mengakibatkan zat A dan B berkurang sedangkan zat C bertambah.
Jika ditambah zat B, maka
kesetimbangan akan bergeser ke arah kanan sehingga mengakibatkan zat A dan B
berkurang sedangkan zat C bertambah.
Jika ditambah gas C, maka kesetimbangan akan bergeser ke arah kiri sehingga mengakibatkan zat A dan B bertambah sedangkan zat C berkurang.
Jika gas C dikurangi, maka
kesetimbangan akan bergeser ke arah kanan sehingga mengakibatkan zat A dan B
berkurang sedangkan zat C bertambah.
Jika pada suatu reaksi setimbang homogen berfase gas, tekanan pada sistem kesetimbangan diperbesar akibatnya volum diperkecil maka reaksi kesetimbangan akan bergeser ke arah yang jumlah molekul (jumlah koefisien) yang kecil dan sebaliknya.
Ketentuan di atas berlaku juga untuk kesetimbangan heterogen, asal pada peninjauan koefisien zat hanya untuk zat yang berfase gas.
Coba Anda bayangkan jika Anda mempunyai sebuah alat suntik yang didalamnya terdapat kesetimbangan gas:
kemudian Anda memberi 2 perlakuan terhadap alat tersebut.
Apa yang terjadi dengan gas-gas yang berada dalam keadaan setimbang dalam alat suntik?
b. Penghisap alat suntik ditarik (volum diperbesar).
Apa yang terjadi dengan gas-gas
yang berada dalam keadaan setimbang dalam alat suntik?
Jika pada suatu reaksi setimbang homogen berfase gas, tekanan pada sistem kesetimbangan diperbesar akibatnya volum diperkecil maka reaksi kesetimbangan akan bergeser ke arah yang jumlah molekul (jumlah koefisien) yang kecil dan sebaliknya.
Ketentuan di atas berlaku juga untuk kesetimbangan heterogen, asal pada peninjauan koefisien zat hanya untuk zat yang berfase gas.
3.
Pengaruh Perubahan Suhu
Jika suhu diturunkan terjadi
pergeseran kesetimbangan ke pihak eksoterm (∆H = -)
Contoh :
Ketiga gas tersebut terdapat
dalam keadaan setimbang dalam ruangan tertutup. Berdasarkan data ∆H = - berarti
reaksi ke kanan merupakan reaksi eksoterm, dan sebalikanya reaksi ke kiri merupakan
reaksi endoterm. Jika suhu dinaikan terjadi pergeseran kesetimbangan ke pihak
endoterm (ke kiri) jadi jumlah zat reaktannya bertambah sedangkan jumlah zat
produk berkurang. Jika suhu diturunkan, terjadi pergeseran kesetimbangan ke
pihak eksoterm (ke kanan).
D. Azas Le Chatelier
Azas Le Chatelier mengatakan bahwa jika suatu sistem yang berada dalam keadaan setimbang diberikan suatu aksi maka akan menimbulkan reaksi yang memperkecil aksi tersebut.
Contoh :
Diketahui reaksi setimbang:
Ketiga gas tersebut terdapat
dalam keadaan setimbang dalam ruangan tertutup.
Aksi : tekanan dalam ruang diperbesar
Reaksi : jika mungkin tekanan
harus berkurang.
Tekanan dapat berkurang, jika
molekul-molekul dalam ruang itu berkurang. Molekul-molekul dapat berkurang,
jika terjadi pergeseran ke pihak yang jumlah koefisien kecil yaitu kearah
produk (ke kanan) mengakibatkan gas amonia bertambah, sedangkan gas N2
dan gas H2 berkurang.
E. Tetapan Kesetimbangan
Dalam keadaan setimbang ada suatu
bilangan yang konstan, asal suhu tidak berubah yang disebut konstante
kesetimbangan (K)
1. Tetapan Kc untuk kesetimbangan
homogen:
Kecepatan
reaksi ke kanan, V1
Kecepatan
reaksi ke kiri, V2
Saat
setimbang V1 = V2
Harga Kc yang diperoleh dapat
diartikan sebagai berikut :
a. Jika harga K kecil, berarti
zat-zat ruas kiri sedikit yang bereaksi.
b. Jika harga K besar, berarti zat-zat ruas kanan banyak terbentuk.
Catatan penting untuk tetapan kesetimbangan
1)
Harga K
merupakan harga yang tetap, dan bersifat khas untuk tiap jenis reaksi.
2)
Harga K hanya
bergantung pada suhu, tidak bergantung pada tekanan atau konsentrasi.
3)
Harga K pada
macam-macam suhu berbeda.
Untuk sistem gas harga K dapat dinyatakan dalam tetapan kesetimbangan tekanan (Kp)
2. Tetapan Kc untuk kesetimbangan heterogen
![]() Untuk persamaan reaksi kesetimbangan
:
Untuk persamaan reaksi kesetimbangan
:
4. Hubungan Kc dengan Kp
5. Manfaat Tetapan Kesetimbangan
Tetapan kesetimbangan dapat digunakan untuk :
a. Memberi informasi tentang posisi kesetimbangan. Jika harga Kc atau Kp sangat besar menunjukkan bahwa reaksi ke kanan berlangsung sempurna. Jika harga Kc atau Kp kecil menunjukkan bahwa reaksi ke kanan atau pembentukan produk relatif kecil
b. Meramalkan arah reaksi.
Jika diberikan contoh reaksi
kesetimbangan :
![]()
terdapat 3 kemungkinan harga
perbandingan hasil kali konsentrasi produk pereaksi (Q), yaitu :
a. Kemungkinan I : Q = Kc, berarti sistem dalam kesetimbangan
b.
Kemungkinan
II : Q < Kc, berarti reaksi berlangsung
dan bergeser ke kanan
c.
Kemungkinan
III : Q > Kc, berarti reaksi
berlangsung dan bergeser ke kiri.
F. Kesetimbangan Dissosiasi
Beberapa contoh reaksi dissosiasi setimbang adalah:
![]() Untuk menyatakan perbandingan jumlah zat yang terurai dibanding mula-mula, digunakan istilah derajat dissosiasi (α). Harga derajat dissosiasi 0 < α < 1
Untuk menyatakan perbandingan jumlah zat yang terurai dibanding mula-mula, digunakan istilah derajat dissosiasi (α). Harga derajat dissosiasi 0 < α < 1
Derajat dissosiasi (α) dituliskan sebagai :
Daftar pustaka
Chang, Michael. Chemistry. New York: Mc. Graw
Hill, 2017.
Graham Hill, John Holman. Chemistry in Context.
United Kingdom: Nelson Thornes, 2000.
Raharjo, Sentot Budi. Kimia Jilid 2. Jakarta:
Platinum, 2019.
Roger, Ryan Lawrie dan Norris. Chemistry
Coursebook Cambridge International AS and A Level. New York: Cambridge
University Press, 2014.


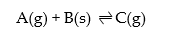




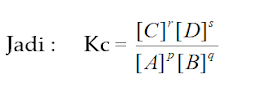

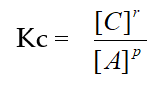












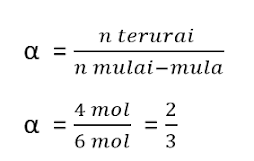





Komentar
Posting Komentar